Published online by Cambridge University Press: 01 July 2024
The compound Mg2+-Al3+-(Fe(CN)6)4−, with a structure similar to hydrotalcite Mg6Al2(OH)16CO3 ·4H2O, is prepared by a coprecipitation method. Chemical, thermal, and X-ray analysis of the compound lead to the formula: (Mg0.741Al0.259(OH)2)((FeII(CN)6)0.067(CO3)0.002(H2O)1.05)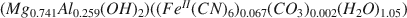
The compound is dehydrated at 100° to 250°C, and the adsorption of N2, O2, CO2, and H2 on it is measured at −196°C to room temperature by the volumetric method. The water is removed reversibly from 100° to 200°C, and the interstices after dehyration act as sites of adsorption. When dehydration is carried out at 150°C, the adsorptive activity reaches a maximum. Adsorption isotherms of N2 and O2 at −196°C and of CO2 at room temperature are of the Langmuir type, and the saturated amounts of N2, O2, and CO2 adsorbed are 96.3, 65.2, and 91.8 ml (STP)/g, respectively.
Adsorption isotherms of N2 and O2 at room temperature are of the Henry type. The amount of O2 adsorbed is about 67% of that of N2. The isosteric heats of adsorption at room temperature of N2, O2, and CO2 are 5.1, 4.8, and 11.0 kcal/mol, respectively. A dehydrated product of a Mg2+-Al3+-CO32− compound does not permit adsorption of CO2 at room temperature, but permits the adsorption of H2O. Hence, it has a molecular sieve effect. No adsorption of H2 is observed in any of the compounds tested.
Соединение Mg2+-А13+-[Fe(CN)6]4−, со структурой подобной гидроталь-киту Mg6Аl2(OH)16CO3·4Н2O приготавливается методом соосаждения. Химический, термальный и рентгеновский анализы соединения позволили вывести формулу: 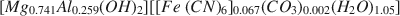
Соединение обезвоживается при температуре от 100°С до 250°С,а адсорбция им N2,O2/СO2 и Н2 измеряется при температуре от −19б°С до комнатной объемным методом. Вода удаляется реверсивно при температуре от 100° до 200°С и промежутки после дегидратации ведут себя как места адсорбции. Адсорбционная активность достигает максимума,когда дегидратация проводится при 150°С. Изотермы адсорбции N2 и O2 при −196°C и СO2 при комнатной температуре являются изотермами типа Лангмуира и адсорбированные количества N2,O2 и СO2 составляют 96,3;65, 2 и 91, 8 мл (С.Т.Д.)/г соответственно.
Изотермы адсорбции N2 и O2 при комнатнои температуре являются изотермами типа Генри. Количество адсорбированного О2 составляет примерно 67% от количества адсорбированного N2.
Изостерическая теплота адсорбции N2,O2 и СO2 при комнатной температуре соответственно равна 5,1; 4,8 и 11,0 ккал/мол. Продукт дегидратации соединения Mg2+-Аl3+-СО32 не адсорбирует СO2 при комнатной температуре, но адсорбирует Н2O. Следовательно, он обладает эффектом молекулярного сита.
Все исследованные соединения не адсорбировали Н2.
Die Substanz Mg(II)-Al(III)-[Fe(CN)6]4−, mit einer Struktur, die Hydrotalkit Mg6Al2(OH)16 CO34H2O ähnelt, wird via einer Mitausfällungs-methode präpariert. Chemische, thermische und Röntgenanalyse der Substanz wies auf die folgende Formel hin: 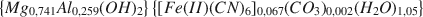
Die Probe wird dehydratisiert bei 100°C bis 200°C und die Adsorption von N2, O2, CO2 und H2 auf der Probe wird bei −196°C bis Zimmertemperatur durch die volumetrische Methode gemessen. Das Wasser ist umkehrbar entfernt bei 100–200°C und nach der Dehydratisierung wirken die Zwischenräume als Adsorptionsplätze. Wenn die Dehydratisierung bei 150°C ausgeführt wird, erreicht die adsorptive Aktivität ein Maximun. Adsorptionsisothermen von N2 und O2 bei 196°C und von CO2 bei Zimmertemperatur gehören zu dem Langmuirtyp und die gesättigten Mengen von N2,O2 und CO2 sind in Reihenfolge: 96,3 65,2, 91,8 ml (S.T.P.) /g.Adsorptionsisothermen von N2 und O2 bei Zimmertemperatur gehören zu dem Henrytyp. Die Menge des adsorbierten O2 ist ungefähr 67 % des N2. Die isosterische Hitze der Adsorption bei Zimmertemperatur von N2, O2 und CO2 sind 5,1 4,8 und 11,0 kcal/mol. Ein dehydratisiertes Produkt einer Mg(II)Al(III)CO32− Substanz erlaubt keine Adsorption bei Zimmertemperatur erlaubt jedoch die Adsorption von Wasser. Daher hat es einen Effekt wie ein Molekularsieb. Adsorption von H2 wird in keinen der getesteten Proben gefunden.
Le composé Mg2+-Al3+-[Fe(CN)6]4+, d'une structure pareille à l'hydrotalcite Mg Al2(OH)16CO3·4H2O est préparé par une méthode de co-précipitation. Des analyses chimiques,thermales et aux rayons-X de ce composé mènent à la formule: 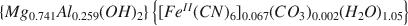
Le compose est deshydraté de 100 à 250 C et l'adsorption de N2,O2, CO2 et H2 est mesurée de −196°C à la température ambiante par la méthode volumétrique. L'eau est retirée réversiblement de 100° à 200°C, et les interstices après désydratation agissent comme des sites d'adsorption. Lorsque la déshydratation se fait à 150°C, l'activité d'adsorp-tion atteint un maximum. Les isothermes d'adsorption de N2 et de O2 à −19 6°C,et de CO2 à température ambiante sont du type Langmuir, et les quantités saturees de N2,O2 et de CO2 adsorbées sont respectivement de 96.3, 65.2 et 91.8 ml (S.T.P.)/g.
Les isothermes d'adsorption de N2 et O2 à température ambiante sont du type Henry. La quantité d'O2 adsorbée est à peu près 67% de celle de N. Les chaleurs isostérigues d'adsorption de N2,O2 et de CO2 à température ambiante sont respectivement de 5.1, 4.8, et 11.0 Kcal/mol. Un produit déshydraté d'un composé Mg2+-Al3+-CO32− ne permet pas l'adsorption de CO2 à température ambiante, mais permet l'adsorption d'H2O.L’ effet est donc celui d'un tamis moléculaire. L'adsorption d'H2 n'a été observé dans aucun des composés testés.